重组人干扰素α-2b(rhIFNα-2b)在重组大肠杆菌表达时为包涵体,其分子量约为18 kD,等电点约为6,根据以上特性设计的纯化工艺路线如图1(1)所示。
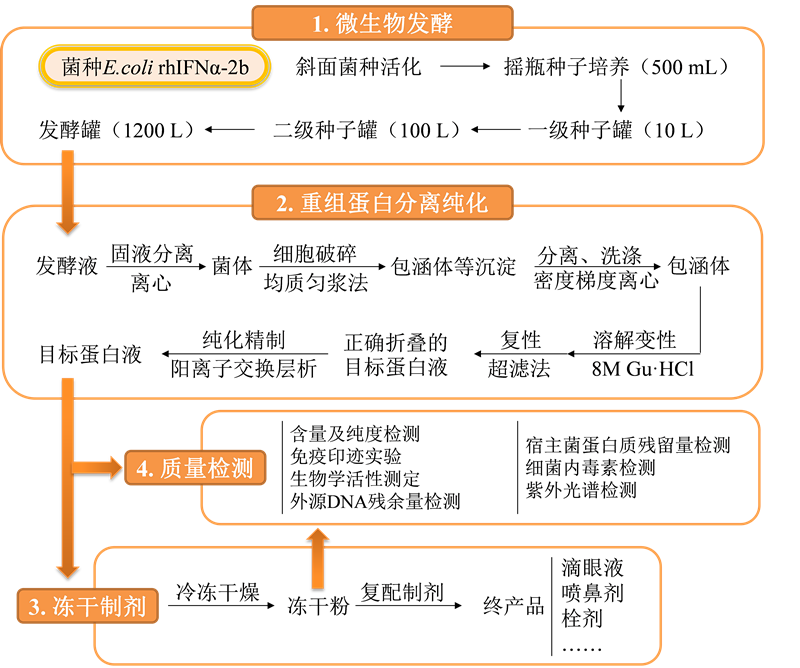
包涵体定义:微生物表达的蛋白在细胞内凝集,形成无活性的固体颗粒。一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白、质粒DNA、脂体、脂多糖等杂质,大小为0.5-1μm,具有很高的密度(约1.3mg/mL),无定形,不溶于水,只溶于高浓度蛋白变性剂。
变复性:包涵体本身无活性,必须通过溶解变性再复性至有活性的目标蛋白。常用的变性剂为尿素(Urea)、盐酸胍(GuHCl)、SDS;对于含有半胱氨酸的蛋白质,分离的包涵体中通常含有一些链间或链内的二硫键,在变性时需要用还原剂将二硫键打断,常用还原剂:二硫基苏糖醇(DTT),2-巯基乙醇(2-ME),还原型谷胱甘肽(GSH)。复性是指通过缓慢去除变性剂使目标蛋白从变性的完全伸展状态恢复到正常的折叠结构。常用的复性方法:透析复性法、稀释复性法、超滤复性法、柱上复性法。
离子交换层析:利用离子交换树脂作为吸附剂(固定相),将溶液中的待分离组分,依据其电荷差异,依靠库仑力吸附在树脂上,然后利用合适的洗脱剂(流动相)将吸附质从树脂上洗脱下来,达到分离的目的。按活性基团,可分为阳离子交换和阴离子交换树脂,具体又可以分为:强阳、弱阳、强阴、弱阴。
离子交换的一般过程:
(1)平衡阶段:离子交换剂与反离子结合
(2)吸附阶段:样品与反离子进行交换
(3)解吸附阶段(洗脱):用梯度缓冲溶液洗脱,先洗下弱吸附物质,后洗下强吸附物质
(4)再生阶段:用原始平衡液进行充分洗涤,既可重复使用
本项目采用SP Sepharose Fast Flow为强阳离子交换树脂:树脂带负电荷,吸附阳离子,与阳离子交换。


